GENERALIDADES SOBRE ENZIMAS

LAS ENZIMAS COMO CATALIZADORES BIOLÓGICOS.
Definiciones y Unidades de actividad
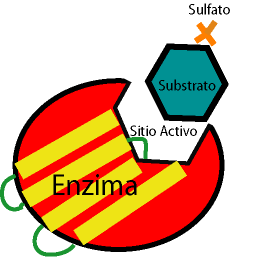
Las enzimas son biocatalizadores complejos de gran especificidad y eficiencia, producidos por las células de organismos vivos, que aumentan la velocidad de las reacciones biológicas a través de vías bien definidas y cuya actividad está sujeta a regulación. Las sustancias sobre las que actúan las enzimas, transformándolas, se denominan substratos.La actividad de las enzimas se expresa generalmente por la, velocidad de la reacción catalizada, a través de las siguientes
UNIDADES:
UNIDAD INTERNACIONAL DE ACTIVIDAD ENZIMÁTICA: Es la cantidad de enzima que cataliza la transformación de 1 micromol de substrato por minuto, bajo condiciones bien definidas (condiciones estándar). Esta es la expresión básica de la velocidad de la reacción. Se ha sugerido que la temperatura debe ser, en lo posible, de 30°C y que las otras condiciones, tales como pH y concentraciones de substratos, debieran ser las óptimas para la actividad enzimática.
KATAL (símbolo: kat):
Es la cantidad de enzima que cataliza la transformación de 1 mol de substrato por segundo. Esta unidad ha sido introducida recientemente por la Unión Internacional de Bioquímica 1 kat = 6 xunidades internacionales.
La Unidad Anson se ocupa cuando se usa hemoglobina como substrato: 1 Unidad Anson = aquella cantidad de enzima que, bajo las condiciones del test, libera 1 mmol (1 milimol =mol) de aminoácidos positivos al reactivo de Folin por minuto, calculados como tirosina. La miliunidad Anson corresponde a 1
mol (=
mol) de tirosina.
(El R. de Folin - Ciocalteu para fenoles contiene tungstato y molibdato de sodio, sulfato de litio, HC1,y bromo y da color violeta con los aminoácidos fenólicos) (36,76).
ACTIVIDAD ESPECÍFICA:
Es el número de unidades de enzima por mg de proteína. Es una medida muy utilizada para expresar la actividad de preparaciones enzimáticas.
ACTIVIDAD MOLECULAR
(número de recambio): Es el número de moléculas de substrato, transformadas, por minuto, por una molécula de enzima. Se calcula dividiendo la velocidad máxima de la enzima por el peso molecular; es una característica de las enzimas individuales y no refleja la pureza de la preparación.
Si la enzima respectiva contiene un grupo prostético, una coenzima o un centro catalítico (véanse éstos más adelante), cuya concentración sea medible, la actividad enzimática puede expresarse también por el número de moléculas de substrato, transformadas por minuto, por cada centro catalítico (10).
. Estructura de las enzimas.
Son proteínas cuyo peso molecular cubre un amplio rango. Por ej., La ribonucleasa, que hidroliza los ácidos ribonucleicos, tiene un PM de 13.700 daltons y está constituida por una sola cadena polipeptídica de 124 aminoácidos. En cambio, la aldolasa, una enzima implicada en el metabolismo de la glucosa, está constituida por 4 subunidades de 40.000 daltons cada una.
Cofactores y Coenzimas (4-9).
Existen enzimas cuya función catalítica se debe exclusivamente a su naturaleza proteica, pero hay otras en que sus propiedades catalíticas, aunque relacionadas con su naturaleza proteica, dependen para su actividad óptima de la presencia de una estructura no proteica y termoestable llamada cofactor. Los cofactores pueden ser simples iones inorgánicos
o sustancias orgánicas más o menos complejas. Cuando los cofactores orgánicos están fuertemente unidos a la proteína enzimática (por enlace covalente) y son específicos para esa enzima, se denominan grupos prostéticos (p. ej., el grupo de la hemoglobina). Si los cofactores orgánicos están más débilmente unidos (interacción no covalente) a la proteína y por ello no se asocian a ella permanentemente (generalmente se unen sólo en el curso de la reacción), se denominan coenzimas. La mayoría de estas coenzimas derivan de las vitaminas, especialmente las del complejo B. Muchas dishidrogenasas requieren la coenzima nicotinamida-adenina-dinucleótido (NAD+) o su derivado de fosfato (NADP+), las cuales provienen de la niacina.

El ácido pantoténico es un componente esencial de la coenzima A, la cual funciona como un transportador transitorio de grupos acilo en el metabolismo. La biotina es un transportador deen las enzimas que catalizan ciertas reacciones de carboxilación y decarboxilación. El ácido tetrahidrofólico, una forma reducida de la vitamina, el ácido fálico, participa en las reacciones de transferencia de grupos de un átomo. La vitamina B12, en su forma de coenzima, funciona en la transferencia de grupos alquilo de ciertas reacciones enzimáticas.
En el lenguaje corriente de la enzimología, el componente proteico se denomina apoenzima y el complejo completo de proteína y cofactor se llama holoenzima. Generalmente la apoenzima es inactiva como catalizador. Algunas enzimas requieren dos o tres cofactores distintos y corrientemente uno de ellos es un ion metálico.
Substratos de Enzimas.

Constituyen las sustancias que son transformadas específicamente por las enzimas.
Se usan para medir la actividad catalítica de las enzimas y, secundariamente, también para determinar el carácter especifico de una acción enzimática.
Para que una sustancia sea apropiada como substrato de una enzima debe reunir los siguientes requisitos:
a) Que experimente una transformación bien definida por la acción catalítica de la enzima;
b) Que sea específica para la enzima respectiva o el grupo muy restringido de enzimas. Ej.: el almidón para las alfa- y beta- amilasas;
c) Que según las condiciones del ensayo, previamente fijadas, no sufra una descomposición espontánea o produzca otras reacciones no catalizadas por la enzima;
d) Que la transformación del substrato que es catalizada por la enzima. Sea fácilmente medible. Ejemplos son los siguientes:
- formación estequiométrica de un producto coloreado;
- una modificación definida en la absorción al ultravioleta (ej.:NADH;
- liberación de un ácido o de un álcali que sean medibles por titulación (ej.: liberación de carboxilos en la pectina por la pectino-estearasa);
- si no se dan estas posibilidades, por acoplamiento con otras reacciones químicas o enzimáticas, llamadas reacciones indicadoras (por ej.: la reacción química (de fosfatasa en leche), del fenol liberado con la dibromoquinon-clorimida para dar indofenol, de color azul).
Otro ejemplo de una segunda reacción enzimática acoplada es la transformación específica de la glucosa por la glucosa-oxidasa en D-glucono-delta-lactona y peróxido de hidrógeno. Este último es desdoblado por adición de peroxidasa con liberación de oxígeno, reconocible por un reactivo cromógeno, que actúa como donador de hidrógeno, como la orto-toluidina o la paraanisidina; midiéndose, finalmente, la intensidad de la coloración resultante.
Los substratos enzimáticos pueden tener dos orígenes:
- Substratos naturales de las respectivas enzimas, como por ej., El almidón (para amilasas) o el etanol (para la alcohol dehidrogenasa);
- Derivados de substratos naturales, obtenidos por síntesis con una estructura química tal que aún son reconocidos y transformados por la respectiva enzima con formación de productos, ya sea coloreados o fácilmente medibles por otro mecanismo. Ejemplos son: 4-nitroanilidas de aminoácidos, para proteasas, y
- nitrofenil-derivados de azúcares, para glucosidasas.
- Derivados de substratos naturales, obtenidos por síntesis con una estructura química tal que aún son reconocidos y transformados por la respectiva enzima con formación de productos, ya sea coloreados o fácilmente medibles por otro mecanismo. Ejemplos son: 4-nitroanilidas de aminoácidos, para proteasas, y
- nitrofenil-derivados de azúcares, para glucosidasas.
Las reacciones químicas se realizan en los seres vivos a gran velocidad, en condiciones muy moderadas de temperatura, pH, presión, etc., gracias a la existencia de catalizadores denominados enzimas. Las enzimas se caracterizan por su notable eficiencia y su extraordinaria especificidad.
La gran mayoría de las enzimas son proteínas, también existe ARN con actividad catalítica (ribozimas). Algunas enzimas son proteínas simples y otras, proteínas conjugadas asociadas con otra molécula no proteica, de pequeño tamaño, la coenzima o cofactor. En función de su naturaleza se denominan:
- Cofactor. Cuando se trata de iones o moléculas inorgánicas. (Cofactores). Algunos cofactores entran a formar parte del sitio activo y son integrantes de la proteína enzima (metaloproteínas) ; otros al parecer, establecen un enlace entre la enzima y el sustrato.
- Coenzima. Cuando es una molécula orgánica. Aquí se puede señalar, que muchas vitaminas funcionan como coenzimas; y realmente las deficiencias producidas por la falta de vitaminas responde más bien a que no se puede sintetizar una determinada enzima en el que la vitamina es la coenzima.
Bibliografia:
PROF. DR. MARIO SAPAG-HAGAR
PROF. DR. HERMANN SCHMIDT-HEBBEL
http://catbioqmed.bravehost.com/contenzi.htm
http://mazinger.sisib.uchile.cl/repositorio/lb/ciencias_quimicas_y_farmaceuticas/schmidth02/parte02/01.html